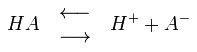Vi riporto la ricetta così com' è.
Tonico alcool free acido salicilico, urea, allantoina
Tonic con il 2% contenuto di acido salicilico, ottenuta senza l'aggiunta di alcool.
Ingredienti per 100g
2% di acido salicilico 2 g - 3,7 ml
1,5% di bicarbonato di sodio 1,5 g - 1,4 ml
3% di urea 3 g - 5 ml
0,5% allantoina 0,5 g
Acido lattico poche gocce
93% di acqua 93 ml
Metodo di esecuzione.
Mescolare il bicarbonato di sodio con acido salicilico, aggiungere acqua e riscaldare a bagnomaria.
La reazione sarà estratto di anidride carbonica (bollicine apparire). Quando riceviamo una soluzione chiara già allantoina sciogliere, quindi togliere il composto dal bagnomaria, attendere che si raffreddi e aggiungere alla fine di urea e acido lattico fino a determinare il pH a 3-4.
NOTA - l'abbassamento del pH al di sotto pH 3, l'acido salicilico, cade dalla soluzione. Effettuare regolamenti del pH della soluzione a freddo. Quando abbiamo raggiunto il pH di 3, ogni goccia di acido lattico provoca la formazione di una sospensione di acido salicilico, che non si dissolvono fino a quando si cambia il pH inferiore a 3
Stabilità del prodotto con un basso pH e contenuto di acido salicilico - almeno 4 - 6 settimane.
Che ne pensate?