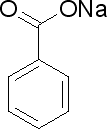
Mi attacco a questo topic per parlare del conservante - potassio sorbato/sodio benzoato e della sua incompatibilità (a mio avviso) con i sali dell’ acido lattico ed acido lattico stesso.
Il tutto è iniziato dalla mia idea malsana di conservare un tonico con la dose generosa (5% circa) di ammonio lattato con questo conservante. E non appena ho aggiunto il sorbato/benzoato alla preparazione tutto mi è andato in “ricotta”. Allora mi sono messa a fare delle prove. Ecco il risultato:
Aceto di mele 10% (pH=3.5) + sorbato/benzoato – soluzione trasparente
Acido citrico 5% (pH=3.0) + sorbato/benzoato – la goccia del conservante fa “la nuvola”, poi la soluzione diventa trasparente.
Acido glicolico 7% (pH=3.0) + sorbato/benzoato – “la nuvola” poi trasparente
Acido lattico 8% (pH=3.0) + sorbato/benzoato – “ricotta”
3-4 gocce di lattico in 100ml d’acqua (pH=5.0) – soluzione trasparente
Sodio lattato 5% (pH=6.0) + sorbato/benzoato – soluzione trasparente, ma non appena si cerca di abbassare il pH (sia con il lattico, sia con il citrico) – “ricotta”
Ammonio lattato 5% (tonico era a ph=5.0) – “ricotta”
Acido lattico 8% + potassio sorbato(10%) – “ricotta”
Acido lattico 8% + sodio benzoato(10%) – fa finta di reggere per 10-15’, poi – “ricotta”
A questo punto penso che quello che fa precipitare il conservante non è il valore di pH, ma la presenza del gruppo lattato in generose quantità. Invece 3-4 gocce di lattico che servano per aggiustare il pH delle preparazioni sembrerebbero non dare il fastidio.
Comunque, se ho detto delle castronerie… bastonatemi pure…

, io ho scoperto dopo che quei conservanti a ph 4 non funzionano