Come fare un detergente in pratica... e in teoria
Moderatori: gigetta, Laura, tagliar, MissBarbara, Bimba80, Paty
-
solita

- utente avanzato

- Messaggi: 3366
- Iscritto il: 10/06/2016, 21:38
- Località: Milano
Re: Come fare un detergente in pratica... e in teoria
Nei promossi hai cercato? Ci sono detergenti bellissimi per ogni gusto
...una???...nessuna...centomila!!!
-
Cake
- utente
- Messaggi: 32
- Iscritto il: 14/04/2022, 0:11
Re: Come fare un detergente in pratica... e in teoria
Sì, ma purtroppo mi mancano quasi tutti i tensioattivi. Ho solo Sles, Betaina, disodio cocoanfodiacetato e coco glucoside & glyceryl olaeate. Farò un altro ordine appena mi sarà possibile.solita ha scritto: 03/05/2023, 14:44 Nei promossi hai cercato? Ci sono detergenti bellissimi per ogni gusto
-
Leonard

- utente avanzato

- Messaggi: 600
- Iscritto il: 03/05/2013, 16:22
Re: Come fare un detergente in pratica... e in teoria
Lo sles non si smonta con gli oli, solo se li aggiungi nel cosmetico finito.Cake ha scritto: 02/05/2023, 19:41 Ciao a tutti. Sto studiando questa sezione. Se volessi provare a formulare un detergente per il corpo, ispirandomi all'inci di un commerciale con cui mi sono trovata bene, contenente, come tensoattivi, solo SLES e Betaina, poi glicerina, oli vegetali (jojoba e Tocoferile acetato) e un solubizzante, quanta percentuale di olio dovrei mettere per rendere meno aggressivi i tensoattivi, che suppongo in questa formula non rispettino il rapporto 1:3, ed evitare che lo sles si smonti?immagino che il solubizzante sia stato inserito in formula proprio per facilitare l'emulsione ed evitare questo, o sbaglio?
Io ho inserito anche il 5% di olio in una formula fatta di sles e cocamidopropyl betaina in un rapporto di 3:1. Puoi inserire uno 0.3% di sale per aumentare la viscosità finale. Ovviamente devi inserire i grassi dopo aver inserito lo sles.
Es:
Acqua
Sale 0.3
glicerina X
Sles 30
Grasso da 1 a 5%
Coco Betaina 10
etc..
Per quanto riguarda il cocoglucoside e glyceryl oleate, puoi tranquillamente inserirlo al 5% (sono andato anche oltre) e per i prodotti per il corpo non è mai un problema. Diversamente se devi inserire una tale quantità di surgrassante in uno shampoo, ti ritroveresti la cute unta il giorno dopo.
Se vuoi un prodotto delicato puoi inserire anche un 10% di glicerina, mitiga l'azione sgrassante della formula.
-
Nordia

- utente avanzato

- Messaggi: 1376
- Iscritto il: 29/04/2021, 20:27
- Località: Monsano AN
Re: Come fare un detergente in pratica... e in teoria
Grazie Leonard.
Per i miracoli ci sta pensando NickAngel97, per tutto il resto c'è.... l'Angolo di Lola!
moira
moira
-
Lola
- Grande Capa

- Messaggi: 48775
- Iscritto il: 28/09/2006, 10:47
- Località: Monfalcone
Re: Come fare un detergente in pratica... e in teoria
Cake già puoi fare detergenti molto belli, certo poi potrai spaziare, ma non è che ti manchi roba.
...perchè io VI VEDO
"Dovrei mettere all'ingresso del forum avete presente quei metal detector tipo negli aeroporti? Quando suona, faccio lasciare giù la scatoletta di bicarbonato e faccio passare solo senza."
"Dovrei mettere all'ingresso del forum avete presente quei metal detector tipo negli aeroporti? Quando suona, faccio lasciare giù la scatoletta di bicarbonato e faccio passare solo senza."
-
SsilviaA

- Spignattatrice

- Messaggi: 9550
- Iscritto il: 27/01/2015, 10:16
- Località: Hogwarts
Re: Come fare un detergente in pratica... e in teoria
Qualcuno riesce a spiegarmi meglio questo concetto?
"La tensione interfacciale è la risultante di due forze tra loro contrapposte, le forze adesive (che fanno in modo che le molecole di due fasi diverse si attraggano) e le forze coesive (che tengono unite fra loro le molecole della stessa fase).
La bagnabilità di un liquido rispetto ad una superficie dipende pertanto dal bilancio di queste due forze. Il potere bagnante di un liquido nei confronti del solido è espresso dall’angolo di contatto.
I tensioattivi, quando dissolti nell'acqua, hanno la capacità di diminuire l’angolo di contatto acqua/fase diversa, così da aumentarne la superficie di contatto.
"La tensione interfacciale è la risultante di due forze tra loro contrapposte, le forze adesive (che fanno in modo che le molecole di due fasi diverse si attraggano) e le forze coesive (che tengono unite fra loro le molecole della stessa fase).
La bagnabilità di un liquido rispetto ad una superficie dipende pertanto dal bilancio di queste due forze. Il potere bagnante di un liquido nei confronti del solido è espresso dall’angolo di contatto.

I tensioattivi, quando dissolti nell'acqua, hanno la capacità di diminuire l’angolo di contatto acqua/fase diversa, così da aumentarne la superficie di contatto.
𝓛𝓾𝓶𝓸𝓼  𝓽𝓸 𝓼𝓱𝓮𝓭 𝓵𝓲𝓰𝓱𝓽 𝓸𝓷 𝓮𝓿𝓮𝓻𝔂𝓽𝓱𝓲𝓷𝓰
𝓽𝓸 𝓼𝓱𝓮𝓭 𝓵𝓲𝓰𝓱𝓽 𝓸𝓷 𝓮𝓿𝓮𝓻𝔂𝓽𝓱𝓲𝓷𝓰
-
Lola
- Grande Capa

- Messaggi: 48775
- Iscritto il: 28/09/2006, 10:47
- Località: Monfalcone
Re: Come fare un detergente in pratica... e in teoria
Partiamo dalle forze coesive: sono quelle che tengono insieme una certa sostanza. Ad esempio l'acqua, se la metti in contatto con una superficie come ad esempio il vetro, o la depositi sull'olio, tenderà non a dividersi in goccioline, ma a rimanere unita in una gocciolona. Questo grazie alle sue forze coesive che la mantengono insieme. Idem per una goccia di olio in acqua.
Però come dicevamo c'è anche l'interazione con il diverso, che sia una fase diversa (l'acqua per l'olio, l'olio per l'acqua, una superficie su cui decidere se spatasciarsi o tenersi talmente rinchiusi in se stessi da mantenere una forma sferica per toccarla il meno possibile).
Il risultato che si ottiene unendo le forze che tengono insieme una fase con quelle che costituiscono il substrato su cui la depositiamo è la tensione interfacciale. Quello che appunto fa che la mia goccia rimanga sferica e non bagni nulla o si spatasci coprendo la maggior superficie possibile della fase disperdente.
Metti la classica goccia di olio in un bicchiere d'acqua: siccome l'acqua ha basso potere bagnante, rimarrà in forma di goccia sferica. Aggiungi detersivo, e di colpo l'olio per lo meno galleggerà a macchia, se il detersivo è di più si emulsionerà.
Però come dicevamo c'è anche l'interazione con il diverso, che sia una fase diversa (l'acqua per l'olio, l'olio per l'acqua, una superficie su cui decidere se spatasciarsi o tenersi talmente rinchiusi in se stessi da mantenere una forma sferica per toccarla il meno possibile).
Il risultato che si ottiene unendo le forze che tengono insieme una fase con quelle che costituiscono il substrato su cui la depositiamo è la tensione interfacciale. Quello che appunto fa che la mia goccia rimanga sferica e non bagni nulla o si spatasci coprendo la maggior superficie possibile della fase disperdente.
Metti la classica goccia di olio in un bicchiere d'acqua: siccome l'acqua ha basso potere bagnante, rimarrà in forma di goccia sferica. Aggiungi detersivo, e di colpo l'olio per lo meno galleggerà a macchia, se il detersivo è di più si emulsionerà.
...perchè io VI VEDO
"Dovrei mettere all'ingresso del forum avete presente quei metal detector tipo negli aeroporti? Quando suona, faccio lasciare giù la scatoletta di bicarbonato e faccio passare solo senza."
"Dovrei mettere all'ingresso del forum avete presente quei metal detector tipo negli aeroporti? Quando suona, faccio lasciare giù la scatoletta di bicarbonato e faccio passare solo senza."
-
marinella59
- utente avanzato

- Messaggi: 1530
- Iscritto il: 24/05/2015, 18:32
Re: Come fare un detergente in pratica... e in teoria
-
SsilviaA

- Spignattatrice

- Messaggi: 9550
- Iscritto il: 27/01/2015, 10:16
- Località: Hogwarts
Re: Come fare un detergente in pratica... e in teoria
Quando abbassi la tensione superficiale allora significa che agisci su queste forze?Lola ha scritto: 13/07/2023, 10:55 Il risultato che si ottiene unendo le forze che tengono insieme una fase con quelle che costituiscono il substrato su cui la depositiamo è la tensione interfacciale.
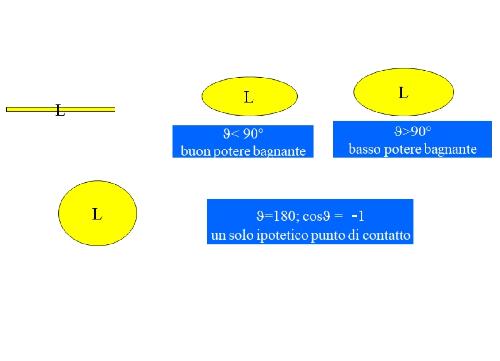
Ok, con la teoria ci siamo. Ma guardando la foto, continuo a non capire cosa intenda:
Dice che theta<90° è un buon potere bagnante, mentre theta>90° è basso potere bagnante. Poi theta=180; cosTheta=-1 (intanto 180 cosa?? Gradi immagino, ma manca il simbolo). Ma theta, per la slide, cos'è?? Sembra darlo per scontato, ma senza legenda io non capisco mica. Quella gialla penso sia la goccia.
Che sia l'angolo formato dalla superficie della goccia?
𝓛𝓾𝓶𝓸𝓼  𝓽𝓸 𝓼𝓱𝓮𝓭 𝓵𝓲𝓰𝓱𝓽 𝓸𝓷 𝓮𝓿𝓮𝓻𝔂𝓽𝓱𝓲𝓷𝓰
𝓽𝓸 𝓼𝓱𝓮𝓭 𝓵𝓲𝓰𝓱𝓽 𝓸𝓷 𝓮𝓿𝓮𝓻𝔂𝓽𝓱𝓲𝓷𝓰
-
lulù58

- utente avanzato

- Messaggi: 4826
- Iscritto il: 08/01/2013, 15:06
- Località: Marche, ma Manfredonia sempre nel cuore
Re: Come fare un detergente in pratica... e in teoria
da Wikipedia: Theta (Θ; θ o ϑ) > In matematica è utilizzato: per indicare un angolo generico ... e si, è l'angolo formato dalla superficie della goccia.
Quindi: angolo inferiore a 90° = buon potere bagnante in quanto aumenta la superficie di contatto; angolo superiore a 90° = basso potere bagnante, in quanto diminuisce la superficie di contatto.
So di non aver detto niente di diverso da quanto detto da Lola, ma non penso si possa spiegare in modo ancora più semplice
EDIT: interessante il PDF che si trova a questo link, tralasciando le espressioni puramente matematiche e concentrandosi solo sulla spiegazione data al capitolo "Bagnabilità"
Ben spiegato anche qui, al capitolo "Svolgimento".
Quindi: angolo inferiore a 90° = buon potere bagnante in quanto aumenta la superficie di contatto; angolo superiore a 90° = basso potere bagnante, in quanto diminuisce la superficie di contatto.
So di non aver detto niente di diverso da quanto detto da Lola, ma non penso si possa spiegare in modo ancora più semplice
EDIT: interessante il PDF che si trova a questo link, tralasciando le espressioni puramente matematiche e concentrandosi solo sulla spiegazione data al capitolo "Bagnabilità"
Ben spiegato anche qui, al capitolo "Svolgimento".
Ultima modifica di lulù58 il 15/07/2023, 16:39, modificato 1 volta in totale.
"... sei un essere speciale ed io avrò cura di te..."
Franco Battiato La cura
La cura
Franco Battiato
-
SsilviaA

- Spignattatrice

- Messaggi: 9550
- Iscritto il: 27/01/2015, 10:16
- Località: Hogwarts
Re: Come fare un detergente in pratica... e in teoria
Io gli angoli li ho sempre nominati anche con alpha o phi, insomma, altre lettere. Sì, anche con theta ma scritto con lo zero sbarrato, non così.
Aaaaaaa ok. Il PDF ha chiarito tutti i dubbi. Eliminerei il link Lulù invece perché è confusionario, nel senso che la riga rossa la fa partire troppo distante dalla goccia e così facendo è anche impossibile arrivare a 90° , quindi diventa concettualmente strano studiarlo. Mentre il PDF è perfetto! Spiega anche a cosa è dovuto l'angolo (e, in pratica, cos'è la riga rossa del link)!! Grazie mille
L'ultimo neanche l'ho guardato perché ho capito
Aaaaaaa ok. Il PDF ha chiarito tutti i dubbi. Eliminerei il link Lulù invece perché è confusionario, nel senso che la riga rossa la fa partire troppo distante dalla goccia e così facendo è anche impossibile arrivare a 90° , quindi diventa concettualmente strano studiarlo. Mentre il PDF è perfetto! Spiega anche a cosa è dovuto l'angolo (e, in pratica, cos'è la riga rossa del link)!! Grazie mille
L'ultimo neanche l'ho guardato perché ho capito
𝓛𝓾𝓶𝓸𝓼  𝓽𝓸 𝓼𝓱𝓮𝓭 𝓵𝓲𝓰𝓱𝓽 𝓸𝓷 𝓮𝓿𝓮𝓻𝔂𝓽𝓱𝓲𝓷𝓰
𝓽𝓸 𝓼𝓱𝓮𝓭 𝓵𝓲𝓰𝓱𝓽 𝓸𝓷 𝓮𝓿𝓮𝓻𝔂𝓽𝓱𝓲𝓷𝓰
-
lulù58

- utente avanzato

- Messaggi: 4826
- Iscritto il: 08/01/2013, 15:06
- Località: Marche, ma Manfredonia sempre nel cuore
Re: Come fare un detergente in pratica... e in teoria
Ohhh, sono veramente contenta che il pdf ti sia servito  ... ho cancellato il primo link
... ho cancellato il primo link 
"... sei un essere speciale ed io avrò cura di te..."
Franco Battiato La cura
La cura
Franco Battiato
-
SsilviaA

- Spignattatrice

- Messaggi: 9550
- Iscritto il: 27/01/2015, 10:16
- Località: Hogwarts
Re: Come fare un detergente in pratica... e in teoria
Siccome il PDF che ha trovato Lulù58 può andare perso, faccio un riassunto.
Bagnabilità
Perché ci interessa: la capacità di un detergente di raggiungere una superficie maggiore è dettata dalla bagnabilità del prodotto stesso, ovvero dal bilanciamento delle forze di coesione e di adesione.
Come diceva la Lola, una goccia liquida su una superficie solida può spargersi o rapprendersi in base all'intensità delle forze di coesione e di adesione.
Forze di coesione -> tengono insieme le sostanze
Forze di adesione -> fanno attrarre sostanze diverse (acqua sul vetro)
Le molecole di un liquido in vicinanza della parete sentono la forza di coesione del fluido Fc diretta verso l’interno del fluido, la forza di adesione liquido-gas Fa,a diretta verso l’interno del gas, la forza di adesione liquido-solido Fa,s diretta verso l’interno del solido. La Fa,a è così debole da poter essere trascurata.
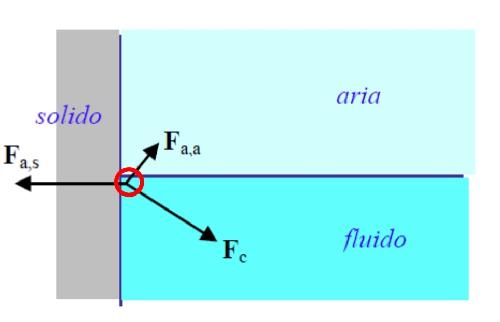
Quando le forze di adesione sono grandi rispetto alle forze di coesione, il liquido tende a bagnare la superficie, quando invece le forze di adesione sono piccole rispetto a quelle di coesione, il liquido tende a "rifiutare" la superficie.
La bagnabilità è completamente descritta dall'angolo di contatto, definito come l'angolo ϑ formato dall'incontro dell’interfaccia liquido-aria con l’interfaccia liquido-solido.
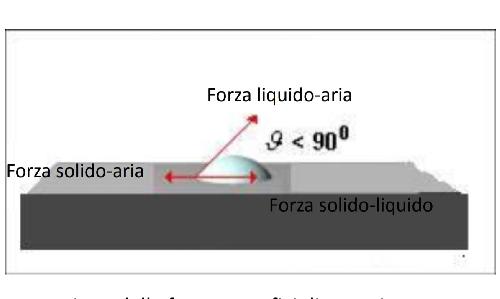
Alla condizione di equilibrio l'angolo di contatto assume valore compreso fra 0° e 180° .
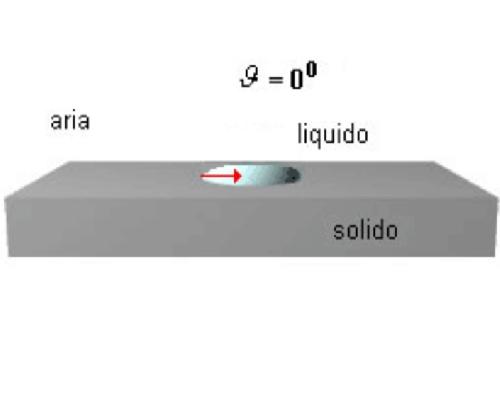
La bagnabilità è massima quando ϑ=0° (cosϑ=1) ed è dovuta ad un bassa tensione superficiale del liquido, ad una bassa tensione interfacciale e ad una grande tensione superficiale del solido. È quello che si verifica, per esempio, quando l'olio si spande sul vetro:
La bagnabilità è parziale quando ϑ<90°(cosϑ<1) ed è particolarmente evidente quando la tensione superficiale del liquido è elevata:
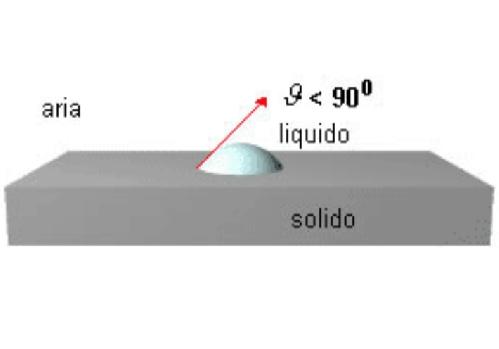
La bagnabilità è scarsa quando ϑ>90° (cosϑ< -1):
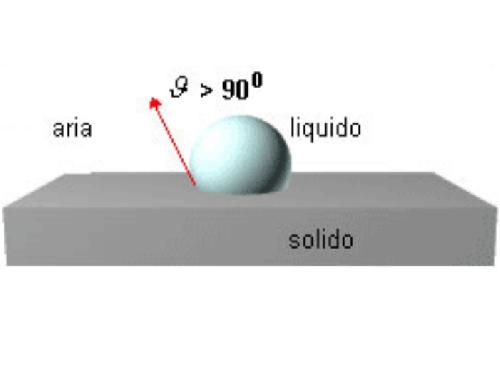
La bagnabilità è nulla quando ϑ=180°ed è conseguente all'elevata tensione interfacciale:
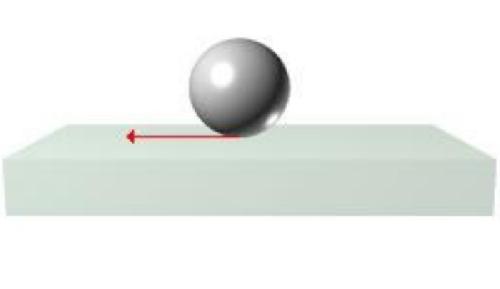
Il bilancio delle forze all'interfaccia è descritta dall'equazione di Young: Flacosϑ=Fsa-Fsl
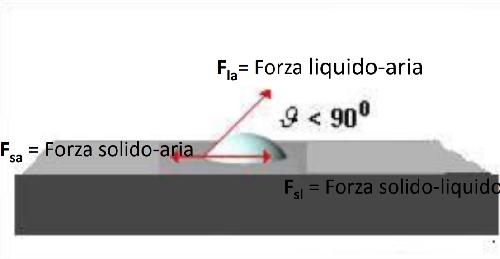
N.B.: nelle immagini qui sopra, l'angolo ϑ si ricava ponendo il vettore (è un vettore perché si sta parlando di forze) rosso parallelo alla superficie grigia, ovvero a 0°, e facendolo ruotare in senso antiorario rispetto alla sua origine fino a toccare nuovamente la superficie grigia, ovvero a 180°.
Per dare concretezza a quanto discusso, possiamo prendere un esempio biologico, osservando che l'angolo di contatto tra l'acqua e lo strato ceroso che riveste le foglie è ottuso, a dimostrazione di una bassa bagnabilità che impedisce la deposizione sulla foglia di uno strato continuo di rugiada in grado di ostruirne i pori.
Spandibilità
Quando un liquido viene depositato su un altro, può spandersi o meno, in conseguenza delle tensioni interfacciali che si stabiliscono tra i due liquidi. Questo fenomeno non può essere trattato vettorialmente (come per la bagnabilità), in quanto la sua soluzione comporta la conoscenza di due angoli, α e β, formati dalle intersezioni dei vettori corrispondenti alle tensioni interfacciali: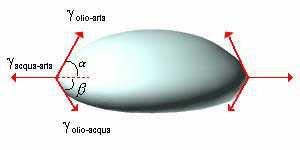
pertanto, ci limiteremo a trattare il fenomeno mediante considerazioni qualitative.
γ(olio-acqua) + γ(olio-aria) < γ(acqua-aria)
dove γ è sempre la tensione superficiale.
Praticamente, questa eguaglianza implica che se la tensione superficiale dell'acqua è maggiore delle altre due tensioni interfacciali, la goccia d'olio verrà "stirata" sull'acqua aumentando la sua superficie di contatto.
Fonti:
http://www.galenotech.org/chimfis4.htm
http://www.galenotech.org/chimfis6.htm
http://www.galenotech.org/tensioattivi.htm
P.s. a me parrebbe interessante anche la parte del calcolo del tensioattivo necessario.
Bagnabilità
Perché ci interessa: la capacità di un detergente di raggiungere una superficie maggiore è dettata dalla bagnabilità del prodotto stesso, ovvero dal bilanciamento delle forze di coesione e di adesione.
Come diceva la Lola, una goccia liquida su una superficie solida può spargersi o rapprendersi in base all'intensità delle forze di coesione e di adesione.
Forze di coesione -> tengono insieme le sostanze
Forze di adesione -> fanno attrarre sostanze diverse (acqua sul vetro)
Le molecole di un liquido in vicinanza della parete sentono la forza di coesione del fluido Fc diretta verso l’interno del fluido, la forza di adesione liquido-gas Fa,a diretta verso l’interno del gas, la forza di adesione liquido-solido Fa,s diretta verso l’interno del solido. La Fa,a è così debole da poter essere trascurata.

Quando le forze di adesione sono grandi rispetto alle forze di coesione, il liquido tende a bagnare la superficie, quando invece le forze di adesione sono piccole rispetto a quelle di coesione, il liquido tende a "rifiutare" la superficie.
La bagnabilità è completamente descritta dall'angolo di contatto, definito come l'angolo ϑ formato dall'incontro dell’interfaccia liquido-aria con l’interfaccia liquido-solido.

Alla condizione di equilibrio l'angolo di contatto assume valore compreso fra 0° e 180° .
La bagnabilità è massima quando ϑ=0° (cosϑ=1) ed è dovuta ad un bassa tensione superficiale del liquido, ad una bassa tensione interfacciale e ad una grande tensione superficiale del solido. È quello che si verifica, per esempio, quando l'olio si spande sul vetro:

La bagnabilità è parziale quando ϑ<90°(cosϑ<1) ed è particolarmente evidente quando la tensione superficiale del liquido è elevata:

La bagnabilità è scarsa quando ϑ>90° (cosϑ< -1):

La bagnabilità è nulla quando ϑ=180°ed è conseguente all'elevata tensione interfacciale:

Il bilancio delle forze all'interfaccia è descritta dall'equazione di Young: Flacosϑ=Fsa-Fsl

N.B.: nelle immagini qui sopra, l'angolo ϑ si ricava ponendo il vettore (è un vettore perché si sta parlando di forze) rosso parallelo alla superficie grigia, ovvero a 0°, e facendolo ruotare in senso antiorario rispetto alla sua origine fino a toccare nuovamente la superficie grigia, ovvero a 180°.
Per dare concretezza a quanto discusso, possiamo prendere un esempio biologico, osservando che l'angolo di contatto tra l'acqua e lo strato ceroso che riveste le foglie è ottuso, a dimostrazione di una bassa bagnabilità che impedisce la deposizione sulla foglia di uno strato continuo di rugiada in grado di ostruirne i pori.
Spandibilità
Quando un liquido viene depositato su un altro, può spandersi o meno, in conseguenza delle tensioni interfacciali che si stabiliscono tra i due liquidi. Questo fenomeno non può essere trattato vettorialmente (come per la bagnabilità), in quanto la sua soluzione comporta la conoscenza di due angoli, α e β, formati dalle intersezioni dei vettori corrispondenti alle tensioni interfacciali:
- γ olio-aria;
- γ acqua-aria;
- γ olio-acqua.

pertanto, ci limiteremo a trattare il fenomeno mediante considerazioni qualitative.
γ(olio-acqua) + γ(olio-aria) < γ(acqua-aria)
dove γ è sempre la tensione superficiale.
Praticamente, questa eguaglianza implica che se la tensione superficiale dell'acqua è maggiore delle altre due tensioni interfacciali, la goccia d'olio verrà "stirata" sull'acqua aumentando la sua superficie di contatto.
Fonti:
http://www.galenotech.org/chimfis4.htm
http://www.galenotech.org/chimfis6.htm
http://www.galenotech.org/tensioattivi.htm
P.s. a me parrebbe interessante anche la parte del calcolo del tensioattivo necessario.
Ultima modifica di SsilviaA il 24/07/2023, 11:13, modificato 1 volta in totale.
𝓛𝓾𝓶𝓸𝓼  𝓽𝓸 𝓼𝓱𝓮𝓭 𝓵𝓲𝓰𝓱𝓽 𝓸𝓷 𝓮𝓿𝓮𝓻𝔂𝓽𝓱𝓲𝓷𝓰
𝓽𝓸 𝓼𝓱𝓮𝓭 𝓵𝓲𝓰𝓱𝓽 𝓸𝓷 𝓮𝓿𝓮𝓻𝔂𝓽𝓱𝓲𝓷𝓰
-
Lola
- Grande Capa

- Messaggi: 48775
- Iscritto il: 28/09/2006, 10:47
- Località: Monfalcone
Re: Come fare un detergente in pratica... e in teoria
Ssilvia la prima immagine non si vede
...perchè io VI VEDO
"Dovrei mettere all'ingresso del forum avete presente quei metal detector tipo negli aeroporti? Quando suona, faccio lasciare giù la scatoletta di bicarbonato e faccio passare solo senza."
"Dovrei mettere all'ingresso del forum avete presente quei metal detector tipo negli aeroporti? Quando suona, faccio lasciare giù la scatoletta di bicarbonato e faccio passare solo senza."
-
SsilviaA

- Spignattatrice

- Messaggi: 9550
- Iscritto il: 27/01/2015, 10:16
- Località: Hogwarts
Re: Come fare un detergente in pratica... e in teoria
Che scatole, l'ho cancellata per sbaglio. Rimedio appena possibile 
𝓛𝓾𝓶𝓸𝓼  𝓽𝓸 𝓼𝓱𝓮𝓭 𝓵𝓲𝓰𝓱𝓽 𝓸𝓷 𝓮𝓿𝓮𝓻𝔂𝓽𝓱𝓲𝓷𝓰
𝓽𝓸 𝓼𝓱𝓮𝓭 𝓵𝓲𝓰𝓱𝓽 𝓸𝓷 𝓮𝓿𝓮𝓻𝔂𝓽𝓱𝓲𝓷𝓰