pH (p minuscolo e H maiuscolo)
e non PH o Ph o ph
ovvero:
p (minuscolo) è l'operatore matematico che significa -Log (in base 10)
H (maiuscolo) è il simbolo chimico dell'idrogeno
quindi pH significa, matematicamente parlando, questo:
-Log [H+]
ovvero il logaritmo in base 10, cambiato di segno per via del "meno" davanti, della concentrazione (simboleggiata dalle parentesi quadre), espressa in moli/litro, degli ioni H+ in soluzione.
In soldoni, il pH misura l’acidità o basicità di una soluzione e, essendo espresso come logaritmo (in base 10) di una concentrazione, una differenza di una unità di pH significa una differenza di 10 volte la concentrazione acida o basica.
Es:
- una soluzione a pH 3 è 10 volte più acida di una a pH 4, 100 volte più acida di una a pH 5 ecc.
- una soluzione a pH 11 è 10 volte più basica di una a pH 10, 100 volte più basica di una a pH 9 ecc.
La neutralità in acqua si ha a pH 7, ovvero a questo pH si ha la stessa concentrazione di ioni H+ (quelli che determinano l’acidità) e di ioni OH- (quelli che determinano la basicità), quindi si ottiene una condizione di neutralità.
Come mai proprio a pH 7 si ha neutralità? Per una proprietà chimica dell’acqua, ovvero della sua costante di equilibrio (vi lascio un link per chi fosse interessato: http://www.chimica-online.it/download/a ... _acqua.htm)
Convenzionalmente, si dice che il pH di soluzioni acquose è compreso tra 0 e 14.
Se faceste due calcoli, vedreste che pH<0 o >14 sono possibili.
Ad esempio (cosa che ho già scritto), in uno dei miei saponi ho preparato la soluzione di soda in questo modo:
acqua: 300 g
soda: 143,9 g
La concentrazione di questa soluzione di soda è circa 10M, ovvero il suo pH è 15.
Analogamente, le soluzioni concentrate di acidi forti, hanno pH ben inferiore a 0 (tipicamente, la soluzione di HCl concentrata che si può usare in laboratorio è al 37%, cioè 12M, ovvero pH circa -1)
Queste soluzioni fortemente acide o basiche hanno pH che rendono sperimentalmente difficile la sua misura elettrochimica e comportano, comunque, deviazioni significative dall'idealità.
Cosa succede quando devo aggiungere gocce di soda alla mia crema per alzare il pH, oppure quando devo aggiungere una soluzione di acido (normalmente lattico o citrico) per abbassare il pH del mio bagnoschiuma?
Succede che soda o acido NON rimangono tali quando li aggiungiamo allo spignatto, ma reagiscono con le sostanze presenti nello spignatto:
es. aggiunta di soda:
• NaOH + HA (sostanze acide come carbomer, acidi vari ecc.) ---> Na+ (ione sodio, lo stesso che si forma quando aggiungiamo il sale da cucina nell’acqua della pasta) + A- (ione derivante dalle sostanze acide) + H2O
es. aggiunta di acido:
• HA (ovvero acido lattico o citrico) + MOH (sostanze basiche come molti tensioattivi ecc.) ---> A- (ione lattato o citrato) + M+ (ione metallico, molto spesso Na+ o K+) + H2O
Il risultato, in entrambi i casi, è la formazione di ioni salini e acqua!!
Non spaventatevi quindi se dovete aggiungere un po’ di soda o acido al vostro spignatto: la basicità o acidità aggiunta diventerà sale e acqua.
Perchè certe volte mi basta aggiungere poche gocce di soda o acido per portare il pH a quello desiderato, mentre per altri spignatti ne devo aggiungere molte di più perchè il pH varia lentamente?
Perché nel nostro spignatto si possono formare sistemi tampone, ovvero sistemi acido-base che si oppongono alle variazioni di pH.
Un esempio di sistema tampone:
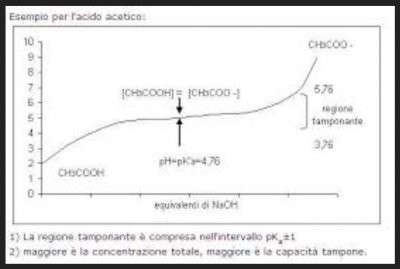
In ordinata (retta verticale) il pH, in ascissa (retta orizzontale) le quantità di soda aggiunte.
Come vedete c'è una zona della curva (quella centrale) piuttosto piatta: questo significa che io aggiungo soda ma il pH varia di poco (nel grafico è indicata con la scritta "regione tamponante" la zona di pH con il massimo potere tampone, caratteristica di ogni coppia acido o base/sale corrispondente).
Nelle zone più laterali (ovvero a pH più bassi o più alti) invece la stessa aggiunta di soda comporta una variazione di pH più accentuata: questo perchè il sistema tampone a quei pH agisce poco.