Bicarbonato di sodio
Moderatori: gigetta, Laura, tagliar, MissBarbara
Regole del forum
in questa sezione NON SI POSTANO INCI
in questa sezione NON SI POSTANO INCI
-
Galatea

- Spignattatrice

- Messaggi: 11072
- Iscritto il: 11/09/2008, 9:55
- Località: S. Gimignano
Re: Bicarbonato di sodio
Nessuno lo ha detto che non si può usare puro, ma la cosa ha lo svantaggio che non sei sicura che ti si sciolga, inoltre frizza ancora di più della soluzione riempendoti la crema di bollicine e minando la stabilità dell'emulsione. Sconsigliamo sia la soluzione che la polvere, con poche differenze tra l'una e l'altra. Rassegnatevi, ci vuole la sodaaaa! 
-
Lola
- Grande Capa

- Messaggi: 47642
- Iscritto il: 28/09/2006, 10:47
- Località: Monfalcone
Re: Bicarbonato di sodio
e quel qualcuno non è di sicuro uno spignattatore autorevole (nel caso lo fosse, sarebbe stato preso per stanchezza)
...perchè io VI VEDO
"Dovrei mettere all'ingresso del forum avete presente quei metal detector tipo negli aeroporti? Quando suona, faccio lasciare giù la scatoletta di bicarbonato e faccio passare solo senza."
"Dovrei mettere all'ingresso del forum avete presente quei metal detector tipo negli aeroporti? Quando suona, faccio lasciare giù la scatoletta di bicarbonato e faccio passare solo senza."
-
Galatea

- Spignattatrice

- Messaggi: 11072
- Iscritto il: 11/09/2008, 9:55
- Località: S. Gimignano
-
marycasi89
- utente avanzato

- Messaggi: 302
- Iscritto il: 19/04/2010, 22:21
- Località: Salerno
Re: Bicarbonato di sodio
Ok!  Soda a go go!!!
Soda a go go!!! 
"La terra non appartiene all'uomo, è l'uomo che appartiene alla terra".
-
Lola
- Grande Capa

- Messaggi: 47642
- Iscritto il: 28/09/2006, 10:47
- Località: Monfalcone
Re: Bicarbonato di sodio
Ma quanto acido citrico ci vuole per neutralizzare perfettamente, senza avanzi, il bicarbonato? Avevo trovato in giro una proporzione 3:1 ma mi pare troppo...
...perchè io VI VEDO
"Dovrei mettere all'ingresso del forum avete presente quei metal detector tipo negli aeroporti? Quando suona, faccio lasciare giù la scatoletta di bicarbonato e faccio passare solo senza."
"Dovrei mettere all'ingresso del forum avete presente quei metal detector tipo negli aeroporti? Quando suona, faccio lasciare giù la scatoletta di bicarbonato e faccio passare solo senza."
-
tagliar

- Moderatrice VIP

- Messaggi: 19768
- Iscritto il: 29/09/2006, 9:57
- Località: Milano
Re: Bicarbonato di sodio
3:1 significa 3 molecole di bicarbonato di sodio ogni molecola di acido citrico (che è un acido triprotico, cioè con 3 atomi di H acidi), ma se ragioniamo in termini di peso il rapporto diventa 1,31 cioè 131 g di bicarbonato di sodio reagiscono completamente con 100 g di acido citrico.

“Siate felici e se qualche volta la felicità si scorda di voi, voi non vi scordate della felicità” (R. Benigni)
-
ros&nn6
- utente avanzato

- Messaggi: 356
- Iscritto il: 11/03/2014, 7:34
- Località: Torino
Re: Bicarbonato di sodio
Esiste un comodissimo bilanciatore on oline per le reazioni chimiche. Si imposta l'equazione ed è sufficiente cambiare i parametri.
Ecco come 100 gr di citrico si combinano con 131,17 gr di bicarbonato oppure 100 gr di bicarbonato con 76 gr di citrico.
Uso da sempre questo calcolatore (webqc.org).
Ecco come 100 gr di citrico si combinano con 131,17 gr di bicarbonato oppure 100 gr di bicarbonato con 76 gr di citrico.
Uso da sempre questo calcolatore (webqc.org).


-
Ricky

- Spignattatore

- Messaggi: 554
- Iscritto il: 13/08/2014, 19:07
Re: Bicarbonato di sodio
Allora avevo fatto i calcoli giusti?tagliar ha scritto:3:1 significa 3 molecole di bicarbonato di sodio ogni molecola di acido citrico (che è un acido triprotico, cioè con 3 atomi di H acidi), ma se ragioniamo in termini di peso il rapporto diventa 1,31 cioè 131 g di bicarbonato di sodio reagiscono completamente con 100 g di acido citrico.
Anche a me veniva così ma mi sembrava troppo facile, pensavo di dovere considerare altri equilibri
Design your universe
Indoctrinated minds so very often Contain sick thoughts And commit most of the evil they preach against
-Epica
Nothing lasts forevermore
-Xandria
L'ossigeno ci vuole morti
cit. mio prof
Indoctrinated minds so very often Contain sick thoughts And commit most of the evil they preach against
-Epica
Nothing lasts forevermore
-Xandria
L'ossigeno ci vuole morti
cit. mio prof
-
tagliar

- Moderatrice VIP

- Messaggi: 19768
- Iscritto il: 29/09/2006, 9:57
- Località: Milano
Re: Bicarbonato di sodio
La reazione stechiometrica è questa, 3:1
*ros&nn6: ma come si usa quel calcolatore (è questo, vero? http://it.webqc.org/balance.php)? Non ci riesco.
*ros&nn6: ma come si usa quel calcolatore (è questo, vero? http://it.webqc.org/balance.php)? Non ci riesco.

“Siate felici e se qualche volta la felicità si scorda di voi, voi non vi scordate della felicità” (R. Benigni)
-
ros&nn6
- utente avanzato

- Messaggi: 356
- Iscritto il: 11/03/2014, 7:34
- Località: Torino
Re: Bicarbonato di sodio
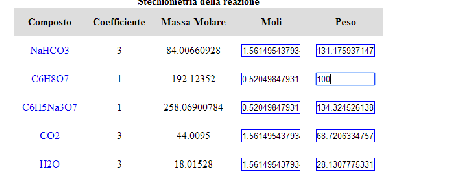
Tagliar, è proprio quello il sito. Scrivi la reazione con le formule brute delle sostanze che devono reagire. In questo caso:
C6H8O7 + NaHCO3 e clicca su "Bilancia".
In automatico ti propone le reazioni già bilanciate presenti in archivio. Se clicchi sulla prima che ti propone, in questo caso:
C6H8O7 + NaHCO3 = CO2 + H2O + Na3C6H5O7
Appena la selezioni, ti apre la stechiometria.
L'ultima colonna è quella del peso.
Se in corrispondenza dell'acido citrico (C6H8O7) scrivi 100, in automatico bilancia tutti i pesi e ti dice che reagiscono con 131,17 gr di NaHCO3, si sviluppano 38 grammi di CO2, richiede 28 gr di acqua e si forma la nostra futura ballistica da 134 gr.
Ti allegherei le foto, ma in ufficio ho operatività limitata col pc
p.s. puoi impostare anche quello che vuoi con le moli. E' davvero utile. L'ho usato all'inzio per capire le quantità necessarie per creare sodio citrato, sia usando soda caustica o carbonato di sodio o bicarbonato di sodio. In rete trovavo sempre dosi un po' "sballate".
C6H8O7 + NaHCO3 e clicca su "Bilancia".
In automatico ti propone le reazioni già bilanciate presenti in archivio. Se clicchi sulla prima che ti propone, in questo caso:
C6H8O7 + NaHCO3 = CO2 + H2O + Na3C6H5O7
Appena la selezioni, ti apre la stechiometria.
L'ultima colonna è quella del peso.
Se in corrispondenza dell'acido citrico (C6H8O7) scrivi 100, in automatico bilancia tutti i pesi e ti dice che reagiscono con 131,17 gr di NaHCO3, si sviluppano 38 grammi di CO2, richiede 28 gr di acqua e si forma la nostra futura ballistica da 134 gr.
Ti allegherei le foto, ma in ufficio ho operatività limitata col pc
p.s. puoi impostare anche quello che vuoi con le moli. E' davvero utile. L'ho usato all'inzio per capire le quantità necessarie per creare sodio citrato, sia usando soda caustica o carbonato di sodio o bicarbonato di sodio. In rete trovavo sempre dosi un po' "sballate".

-
tagliar

- Moderatrice VIP

- Messaggi: 19768
- Iscritto il: 29/09/2006, 9:57
- Località: Milano
Re: Bicarbonato di sodio
Io avevo provato con i nomi delle sostanze, ma alcuni li prendeva e altri no.
Grazie!!
Grazie!!

“Siate felici e se qualche volta la felicità si scorda di voi, voi non vi scordate della felicità” (R. Benigni)
-
lamia
- utente avanzato

- Messaggi: 272
- Iscritto il: 15/02/2010, 21:25
- Località: prov.VA
-
ros&nn6
- utente avanzato

- Messaggi: 356
- Iscritto il: 11/03/2014, 7:34
- Località: Torino
Re: Bicarbonato di sodio
E' "permaloso" se scrivi le formule senza usare maiuscole e minuscole corrette. In genere, le reazioni più comuni si trovano tutte.
Complimenti a te che hai fatto i calcoli senza lo strumento: io sono pigra e cerco sempre il massimo risultato al minimo sforzo. Buon divertimento ^^
Complimenti a te che hai fatto i calcoli senza lo strumento: io sono pigra e cerco sempre il massimo risultato al minimo sforzo. Buon divertimento ^^

-
natu
- novellino

- Messaggi: 14
- Iscritto il: 27/06/2016, 11:57
Re: Bicarbonato di sodio
sono un "nuovo novellino", non mi è chiara una cosa:
da quanto ricordo il ph consigliato per i deodoranti varia fra il 4.5 e 5.0.
Ma quindi perchè se andiamo a produrre un deodorante a base di soluzione satura di bicarbonato di sodio va bene anche a ph 8? è forse perchè l'azione "battericida antiodorante" di quest'ultima sostanza funge solamente a ph 8?

da quanto ricordo il ph consigliato per i deodoranti varia fra il 4.5 e 5.0.
Ma quindi perchè se andiamo a produrre un deodorante a base di soluzione satura di bicarbonato di sodio va bene anche a ph 8? è forse perchè l'azione "battericida antiodorante" di quest'ultima sostanza funge solamente a ph 8?
-
Lola
- Grande Capa

- Messaggi: 47642
- Iscritto il: 28/09/2006, 10:47
- Località: Monfalcone
Re: Bicarbonato di sodio
anche il sapone è basico e te lo devi tenere così... il bicarbonato dà reazione basica e se lo acidifichi non è più bicarbonato, una parte se ne va in anidride carbonica, e non funziona più.
...perchè io VI VEDO
"Dovrei mettere all'ingresso del forum avete presente quei metal detector tipo negli aeroporti? Quando suona, faccio lasciare giù la scatoletta di bicarbonato e faccio passare solo senza."
"Dovrei mettere all'ingresso del forum avete presente quei metal detector tipo negli aeroporti? Quando suona, faccio lasciare giù la scatoletta di bicarbonato e faccio passare solo senza."
-
Bimba80

- moderatrice

- Messaggi: 5959
- Iscritto il: 27/12/2008, 15:52
- Località: Puglia
Re: Bicarbonato di sodio
Domanda: uso il bicarbonato per sciogliere il salicilico nello shampoo, a lungo andare non può danneggiare i capelli? Uso 0,4 di bicarbonato su 0,6 di salicilico.
Leggendo il topic in trattamenti dei capelli è sconsigliato l'uso per vari motivi, ma lì si usa puro o si fanno impacchi, mi è venuto questo dubbio anche se la quantità è davvero poca.
pH shampoo 5 dovrebbe andar bene.
Leggendo il topic in trattamenti dei capelli è sconsigliato l'uso per vari motivi, ma lì si usa puro o si fanno impacchi, mi è venuto questo dubbio anche se la quantità è davvero poca.
pH shampoo 5 dovrebbe andar bene.
-
Lola
- Grande Capa

- Messaggi: 47642
- Iscritto il: 28/09/2006, 10:47
- Località: Monfalcone
Re: Bicarbonato di sodio
non gli fa niente, poi se lo shampoo è a pH acido e non 9 comesono ,e soluzioni acquose di bicarbonato, questo si é già scisso in anidride carbonica e cosa rimane in soluzione, ioni di sodio vaganti (sono millenni che non faccio un'ossido riduzione, qualcuno fresco di studi chiarirebbe la reazione? )
Comunque niente che faccia male ai capelli.
Comunque niente che faccia male ai capelli.
...perchè io VI VEDO
"Dovrei mettere all'ingresso del forum avete presente quei metal detector tipo negli aeroporti? Quando suona, faccio lasciare giù la scatoletta di bicarbonato e faccio passare solo senza."
"Dovrei mettere all'ingresso del forum avete presente quei metal detector tipo negli aeroporti? Quando suona, faccio lasciare giù la scatoletta di bicarbonato e faccio passare solo senza."
-
Bimba80

- moderatrice

- Messaggi: 5959
- Iscritto il: 27/12/2008, 15:52
- Località: Puglia
Re: Bicarbonato di sodio
Grazie per la spiegazione. 
-
tagliar

- Moderatrice VIP

- Messaggi: 19768
- Iscritto il: 29/09/2006, 9:57
- Località: Milano
Re: Bicarbonato di sodio
Nessuna ossidoriduzione: a pH acido rimangono acqua e ioni sodio.

“Siate felici e se qualche volta la felicità si scorda di voi, voi non vi scordate della felicità” (R. Benigni)
-
Lola
- Grande Capa

- Messaggi: 47642
- Iscritto il: 28/09/2006, 10:47
- Località: Monfalcone
Re: Bicarbonato di sodio
perchè il carbonato è diventato anidride carbonica, giusto?
...perchè io VI VEDO
"Dovrei mettere all'ingresso del forum avete presente quei metal detector tipo negli aeroporti? Quando suona, faccio lasciare giù la scatoletta di bicarbonato e faccio passare solo senza."
"Dovrei mettere all'ingresso del forum avete presente quei metal detector tipo negli aeroporti? Quando suona, faccio lasciare giù la scatoletta di bicarbonato e faccio passare solo senza."